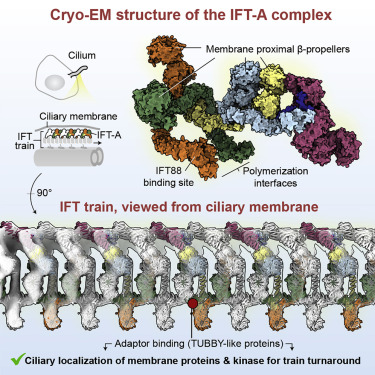
英国伦敦伯克贝克大学Anthony J. Roberts等研究人员合作通过IFT-A结构揭示膜蛋白进入纤毛的载体。这一研究成果于2022年12月2日在线发表在国际学术期刊《细胞》上。
研究人员表示,纤毛内运输(IFT)列车是巨大的分子机器,在纤毛和细胞体之间运输蛋白质。每个IFT列车是由两个大型复合物(IFT-A和-B)和运动蛋白组成的动态聚合体,对机制的理解构成了巨大的挑战。
研究人员重组了完整的人类IFT-A复合物,并使用冷冻电镜获得了它的结构。结合AlphaFold预测和基因组编辑研究,研究人员阐明了IFT-A如何聚合、与IFT-B相互作用,并利用一系列β-螺旋桨和TPR结构域来创建IFT列车的“车厢”,使TULP适配蛋白参与其中。研究人员表明,IFT-ATULP车厢对于不同的膜蛋白的纤毛定位以及ICK(调节IFT列车转弯的关键激酶)是必不可少的。
这些数据建立了IFT-A不同功能之间的结构联系,提供了IFT-A在火车上的蓝图,并揭示了IFT如何从原包被体的祖先演化过来。
附:英文原文
Title: IFT-A structure reveals carriages for membrane protein transport into cilia
Author: Sophie J. Hesketh, Aakash G. Mukhopadhyay, Dai Nakamura, Katerina Toropova, Anthony J. Roberts
Issue&Volume: 2022-12-02
Abstract: Intraflagellar transport (IFT) trains are massive molecular machines that traffic proteins between cilia and the cell body. Each IFT train is a dynamic polymer of two large complexes (IFT-A and -B) and motor proteins, posing a formidable challenge to mechanistic understanding. Here, we reconstituted the complete human IFT-A complex and obtained its structure using cryo-EM. Combined with AlphaFold prediction and genome-editing studies, our results illuminate how IFT-A polymerizes, interacts with IFT-B, and uses an array of β-propeller and TPR domains to create “carriages” of the IFT train that engage TULP adaptor proteins. We show that IFT-ATULP carriages are essential for cilia localization of diverse membrane proteins, as well as ICK—the key kinase regulating IFT train turnaround. These data establish a structural link between IFT-A’s distinct functions, provide a blueprint for IFT-A in the train, and shed light on how IFT evolved from a proto-coatomer ancestor.
DOI: 10.1016/j.cell.2022.11.010
Source: https://www.cell.com/cell/fulltext/S0092-8674(22)01422-2
